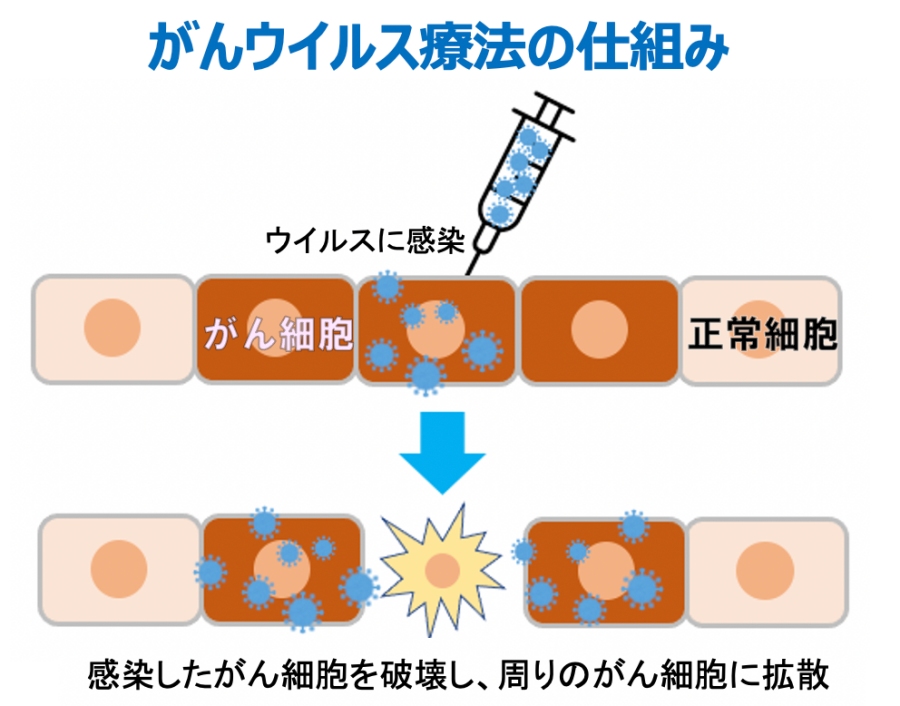
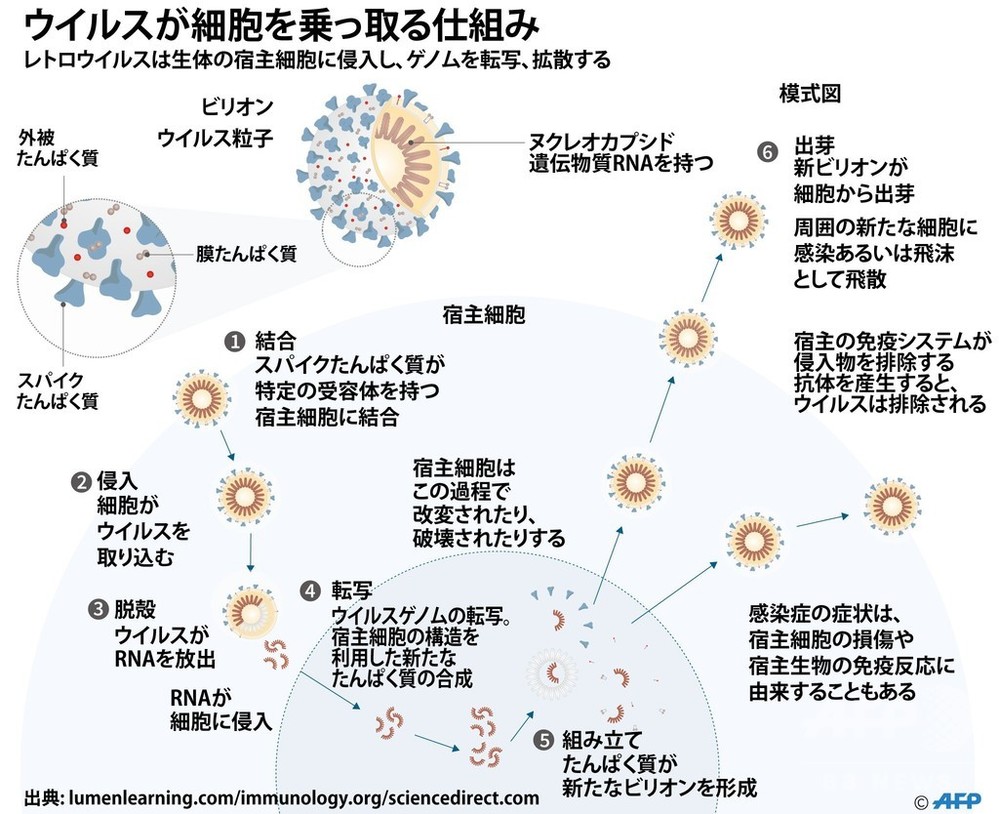
腫瘍溶解性ウイルス(しゅようようかいせいウイルス、英: oncolytic virus)とは、悪性腫瘍(癌)の細胞に感染してこれを細胞死させるウイルスの総称である。感染した癌細胞は融解し、感染性を持つ新たなウイルス粒子を放出して他の癌細胞に感染する。腫瘍溶解性ウイルスは腫瘍細胞を直接死に至らしめるのみならず、宿主の抗腫瘍免疫活性を上昇させる。
抗腫瘍薬としてのウイルスの可能性は20世紀の初頭から模索され始めた。当初は未精製の新規ウイルスが用いられたが、1960年代になるとウイルスを厳選し精製して使用するようになった。アデノウイルス、レオウイルス、麻疹ウイルス、単純ヘルペスウイルス、ニューカッスル病ウイルス、牛痘ウイルスなどの多くのウイルスが臨床開発の途上にある。最新の腫瘍溶解性ウイルスは、レオウイルスやセネカバレーウイルス(SVV-001)といった自然に存在するウイルスを腫瘍選択性を高めるように改良して作成されており、臨床試験や製造・販売承認に至ったものもある。
2011年時点ではヒトでの試験が実施されたものは少なかった。タリモジン ラヘルパレプベク(OncoVex、T-VEC)は第III相臨床試験の中間解析結果が良好であることを2012年1月に発表し、2015年12月(進行悪性黒色腫の治療薬として)最初に承認されたウイルスとなった。懐疑論者は、発表されなかった全生存期間こそが最終的な判断の材料となることを理由に中間解析結果の臨床的妥当性について疑義を申し立てていた。またこの治療法は他の治療法と組み合わされることで有効性が最大化されるとも言っている。
開発の経緯
腫瘍の縮小とウイルスとの関連性は長い期間理論付けられ、20世紀初頭には子宮頸癌、バーキットリンパ腫、ホジキンリンパ腫の発症(感染)または予防接種で腫瘍が縮退する現象が報告されるようになった。ウイルスの予防接種あるいは意図的な感染による癌治療のための努力は20世紀半ばから始められた。ウイルスの改変技術がいまだなかったことから、研究初期には自然界から腫瘍溶解活性を持つウイルスを見つけ出すことに注力された。1960年代には、ポリオウイルス、アデノウイルス、コクサッキーウイルス、エコーエンテロウイルス(RIGVIR)、その他のウイルスを用いた研究が有望視された。研究初期に多かった合併症はウイルス感染制御の失敗で、疾病罹患や死の転帰を辿った。患者に害はなくとも免疫反応が活性化されることでウイルスが破壊され、癌細胞を破壊できないことが非常に多かった。最初期にはウイルス療法で治療可能な癌腫は非常に限られていると考えられていた。腫瘍縮小が見られた場合でも、それは完全奏効でも持続的奏効でもなかった。化学療法や放射線療法が発展してきた頃、ウイルス療法は遺棄されるかに見えたが、開発は継続された。癌は依然として主な死因であり新たな治療法が必要とされていた。ウイルス改変に必要な遺伝子工学が開発され、ウイルス療法は新たな局面を迎えた。
単純ヘルペスウイルス
単純ヘルペスウイルス(HSV)は研究が進んでおり遺伝子加工が容易でヒト正常細胞には比較的無害(稀に単純疱疹を生じる)で危険性が低く癌細胞選択的な攻撃特性を有する最初のウイルスであると思われた。1型単純ヘルペスウイルス(HSV-1)の変異体1716はICP34.5遺伝子を欠き、分化し細胞分裂しなくなった細胞内では自己複製できないが、癌細胞に感染して効果的に細胞融解をもたらすもので、癌のウイルス療法に適したものであった。in vivo で癌細胞株を広範囲に検討した結果、HSV1716ウイルスが腫瘍を縮小させ、生存期間を延長することが明らかとなった。
1996年、欧州でHSV1716を用いた治験が初めて実施承認された。1997年から2003年まで、毒性や副作用に関する情報が乏しいまま、HSV1716株は膠芽腫(悪性度の高い脳腫瘍)患者の腫瘍内部に注入され、患者の一部は長期生存した。
その他にHSV1716の安全性を検討する臨床試験が悪性黒色腫ならびに頭頸部扁平上皮癌を対象に実施された。HSV1716の外殻を改変したウイルス株がいくつかの癌の治療に応用され、さまざまな遺伝子を癌細胞に導入できるようになってから、遺伝子に化学療法剤を結合して無害なプロドラッグとして細胞内に侵入させてから内部で切り離して毒性を発現させたり、放射性ヨウ素でタグ付けされた蛋白質を細胞内に濃縮させ、その放射線で癌細胞を破壊するといった手法が開発された。
他のHSV系の腫瘍溶解性ウイルスも開発が進み、臨床試験が実施されるようになった。最も注目すべきものは進行悪性黒色腫に対する極めて重要な第III相臨床試験を終了させたOncoVex GM-CSFであろう。この試験の主要評価項目は生存期間の延長であり、2013年3月に世界で初めてウイルス療法剤として統計学的に高度な有意差を以って示された。アメリカ食品医薬品局(FDA)は 2015年10月27日、皮膚およびリンパ節のメラノーマ病変の治療に対し、初めての腫瘍溶解性ウイルス製剤talimogene laherparepvec(略称:T-VEC、商品名IMLYGIC)を承認した。
Oncorine (H101)
規制当局に初めて承認された腫瘍溶解性ウイルスは、H101と呼ばれる遺伝子改変アデノウイルスであった。H101は2005年に中華人民共和国の国家食品薬品監督管理局(SFDA)から頭頸部癌の治療法として承認された。H101は正常細胞のP53遺伝子(癌細胞では多くの場合調節不全である)と相互作用するウイルス防御作用が取り除かれている点でOnyx-15に極めて類似している。ウイルスの感染細胞選択性は初期のin vivo 研究では確認されていたが臨床試験では不完全であった。しかし、癌細胞を優先的に殺してはいる。全生存期間は未知であるが、奏効率は化学療法単独に比べてH101+化学療法では2倍になった。H101は腫瘍内に直接注入する投与法が最善であるが、発熱は免れない。静脈注射などの全身療法は転移を有する疾患に適している。現在はOncorineという商品名で販売されている。
C-REV (HF10)
日本では1996年に名古屋大学で腫瘍溶解性ウイルスの研究が開始された。単純ヘルペスウイルスの突然変異種であるHF10が初めて論文に掲載されたのは2003年である。また同年、日本で初めてヒトへの投与が実施され、有効性が期待される結果を得た。HF10はその後も研究が進められ、2015年1月にタカラバイオからPMDAに治験計画届が提出され、同年8月に1例目の症例に投与された。
適応の可能性
腫瘍溶解性ウイルスの作用の特異性および可変性は、手術療法、化学療法、放射線療法といった他の治療法で治療しきれない癌を治療し得る可能性を秘めている。腫瘍溶解性ウイルスは重要な研究の一分野であるが、他の治療法を凌駕する結果を示せない間は使用されることはないであろう。従ってウイルス療法は他の治療が無効である患者に対して適用されるべきである。ウイルス療法の利点は、ウイルスが(自身の特性または遺伝子改変の結果)癌細胞に選択的であり、癌細胞に発現している成長因子や受容体をターゲットとすることにある。遺伝子操作をして腫瘍細胞死を起こすある特定の分子(インターロイキン-12、IL-12)を生成する単純ヘルペスウイルス(HSV)などの有効性の検討には、実験動物が用いられている。神経膠芽腫細胞の場合、マウスでは、IL-12増強HSVは腫瘍溶解作用のみならず血管新生抑制作用をも有し、腫瘍への血流を減少させていることが示された。
ウイルスの静脈注射は従来の治療法では手の打ちようのない転移癌に有効である可能性がある。しかし、血流中に放たれたウイルス粒子は抗体に無力化され、クッパー細胞などにより血中から速やかに除去される。
野生株ウイルスの溶腫瘍的挙動
水疱性口内炎ウイルス
水疱性口内炎ウイルス(VSV)は、一本鎖の-鎖RNAゲノムでコードされた5つの遺伝子からなる、ラブドウイルスである。自然界ではVSVは昆虫や家畜類に存在し、比較的局在性非致死性の疾患の原因となる。このウイルスの低病原性は、感染の際に組織中および血中に分泌されるインターフェロンへの感受性による処が大きい。これらの分子は細胞をウイルスの感染から守りウイルスの拡散を抑える遺伝子プログラムを発動する。しかし2000年に、癌細胞ではそのプログラムに欠陥があり、インターフェロンに反応できずにVSVに非常に感染し易いことが明らかにされた。VSVの場合感染から細胞融解までが非常に速く、24時間でウイルス量は1000倍に増殖し、悪性腫瘍細胞は死亡する。従ってVSVは癌治療に非常に適しており、いくつかの研究グループがVSV全身投与後に腫瘍内でVSVが増殖し腫瘍が縮小することを示し、生存期間を延長するケースもあることが明らかとなった、遺伝子操作に基づく基質蛋白質のMet-51の削除による弱毒化によって、腫瘍細胞内での増殖能に影響を与えない範囲で理論的には全ての正常組織への感染が回避された。
2010年の研究に拠ると、このウイルスで脳腫瘍を治療し、快癒できる可能性があるとされる。
ポリオウイルス
ポリオウイルスはその生来的性質として神経細胞への毒性を有するため、自ずと神経由来腫瘍への選択性が存在する。ポリオウイルスは一本鎖の+鎖RNAを持ち、その翻訳はウイルスゲノムの5'非翻訳領域内の組織特異的配列内リボソーム進入部位(IRES)に依存性である。IRESは神経由来細胞内で活性化し、5'末端キャップ無しでウイルス遺伝子を翻訳する。2000年にはポリオウイルスの自然のIRISをライノウイルスのIRISに入れ替え、組織選択性を変更する試みがなされた。その結果作成されたPV1(RIPO) ウイルスは神経膠腫細胞を選択的に破壊し、通常の神経細胞にはダメージを与えなかった。
レオウイルス
REOウイルスとは呼吸器(Respiratory)腸(Enteric)オーファン(Orphan)ウイルスの頭字語であり、一般に哺乳類の呼吸器および消化器に感染する。ほとんどのヒトは成人期までにレオウイルスに曝露されるが、多くの場合無症候性である。レオウイルスの腫瘍溶解性ウイルスとしての応用は、多くの癌細胞株で増殖し細胞融解を示すことが明らかになって以来模索されている。
レオライシンについては各種癌の治療の臨床試験が実施されている。
セネカウイルス
セネカバレーウイルスとしても知られているセネカウイルスは、自然に存在する野生型腫瘍溶解性ピコルナウイルスの一種であり、2001年に組織培養の混入物として発見された。単離されたSVV-001は、NTX-010という名称で神経内分泌作用を持つ癌種―小細胞肺癌やさまざまな小児癌を含む―への抗腫瘍効果が検討されている。
RIGVIR
1960年代にラトビアでエコーウイルスの腫瘍溶解性が研究され、1968年に第IV期の癌患者を対象にエコーエンテロウイルス5株の臨床試験が開始された。エコー-7ウイルス株(後のRIGVIR)が最も顕著な効果を示し、同株の研究が継続されることが決定された。化学療法および放射線療法との有効性の比較を目的として、第III相臨床試験が1988年に開始された。2004年にラトビアでRIGVIRの特許が登録され、それ以降、癌治療に用いられていたが、効果が疑わしく薬品の質にも問題があって、承認は取り下げられている。
開発手法
「指向進化」と呼ばれる薬剤開発の革新的方法は、具体的には、ランダムに遺伝子を組み換えたウイルス前駆体の大集団をスクリーニングし、指向選択と言われる選択段階を経て新たなウイルス変異体または血清型を創製することを含む。この生物学的多様性の増加は初めにウイルス株のプール内での相同的組換をし、一連の選別を経て、ウイルス学的機序が未知のまま治療に適した特性(高腫瘍選択性)を持つウイルスが選択される。これらの候補ウイルスは前臨床試験でさらに絞り込まれ、必要な治療特性を持つウイルスが選抜される。
多くのウイルスが開発されていく中で、指向進化は高選択的で腫瘍溶解特性を保持し続けているヒトアデノウイルスの開発に適用された。その結果、ColoAd1(新しいキメラ型B群アデノウイルス)が生み出された。この血清型Ad11pおよびAd3のハイブリッドアデノウイルスは比較対象のウイルス(Ad5、Ad11p、Ad3など)に比べて良好な有効性と腫瘍選択性を示し、新鮮なヒト結腸癌組織で正常組織より2log(100倍)高い増殖能を示した。
弱毒化
弱毒化の手法には腫瘍組織中で増殖するが正常組織中で増殖しないようにウイルス遺伝子・遺伝子領域を削除するという方法がある。これによりウイルスの安全性と腫瘍選択性が高められる。癌細胞とウイルス感染細胞は細胞内のシグナル伝達経路に同じような変化が起こっており、特に細胞周期の進行に関する経路で顕著である。シグナル伝達経路の変化に関するウイルス遺伝子は経路が不活性な細胞では意味を持たないが、経路が活性化されている細胞では重要である。
細胞中のチミジンキナーゼならびにリボヌクレオシド二リン酸レダクターゼはDNA複製において重要な役割を持ち、細胞分裂をしている細胞中でのみ活性化されている。これらの酵素はいくつかのウイルス(HSV、牛痘ウイルスなど)の遺伝子にも存在し、G0期(静止期、細胞分裂していない)の細胞でのウイルス複製を可能にしている。これらの酵素が変異などで不活性化されると、ウイルスは癌細胞などの増殖中の細胞でのみ自己複製できることになる。
腫瘍選択性
アデノウイルスの腫瘍選択性を高める方法には、大きく分けて形質導入法と非形質導入法の2つがある。
形質導入法には、ウイルスの外殻蛋白質を改変して腫瘍との親和性を高め、同時に非腫瘍細胞への侵入を減少させる方法がある。この方法では腫瘍選択性は主にアデノウイルスとHSV-1で用いられるが他のウイルスでも使用可能である。
非形質導入法には、ウイルスのゲノムを編集してがん細胞内でのみ複製できるようにする方法があり、主にウイルスの弱毒化を目的として行われる。遺伝子の転写をターゲットとすることもあり、この場合はウイルス複製を腫瘍特異的プロモーターの制御下に置く。適切なプロモーターは腫瘍内で活性で正常組織内(特に血中に流出したウイルスに最も曝される肝臓)で不活性なものである。このようなプロモーターはいくつも発見され、癌治療への応用が研究された。同様にウイルスの複製過程はmicroRNA標的改変部位あるいはmiRNA応答因子(MRE)で調節される。健康な組織と腫瘍との間のmiRNAの発現の差は、標的とする組織でウイルスが複製せず腫瘍内で複製するという機能の実装を可能にしている。
形質導入法と非形質導入法の双方を使用すると、片方のみを使用した場合より効果的にウイルスをデザインできる。
レポーター遺伝子
研究所や診療所で実験中のウイルスに感染している細胞を検出する単純な方法があることは有意義である。これはウイルスに「レポーター遺伝子」を組み込んで蛋白質マーカーを発現するようにと掛けておくことで実現される。一例として、緑色蛍光タンパク質(GFP)が挙げられる。これは感染細胞中で産生され、青色光を当てた時に緑色の蛍光を発する。この手法の長所は、患者の表在性感染部位でのウイルス感染を非侵襲的に速やかに確認できることにある。生きている細胞での可視マーカーのもう一つの実例としてルシフェラーゼが挙げられる。ルシフェラーゼはホタルが持つ酵素ルシフェリンの存在下で発光し、特性のカメラでその様子を捉えることができる。
大腸菌の酵素β-グルクロニダーゼおよびβ-ガラクトシダーゼ(en:beta-galactosidase)の遺伝子を持つウイルスが存在する。これらの酵素は、特定の基質があると色素を生成するので、感染細胞を可視化して遺伝子の発現を確認することができる。
抗癌活性増強のための改変
腫瘍溶解性ウイルスはその腫瘍溶解性以外の作用をも持つ場合がある。
自殺遺伝子
ウイルスを自殺遺伝子を運ぶベクターとして用い、別に投与された無毒性のプロドラッグを代謝する酵素を生成して細胞内で細胞毒性を発現させて周囲に拡散し、隣り合った細胞を殺すことができる。チミジンキナーゼ自殺遺伝子を持つ単純ヘルペスウイルスの一つは、臨床試験が第III相まで実施された。SVSチミジンキナーゼは、プロドラッグであるガンシクロビルをリン酸化し、DNA合成経路に紛れ込ませてDNA合成を阻害する。腫瘍溶解性ウイルスの腫瘍選択性は、自殺遺伝子が癌細胞内のみで機能することを保証するが、のみならず周囲の癌細胞に「傍観者効果」を及ぼすことがいくつかの自殺遺伝子系で観察されている。
血管新生抑止
血管新生は腫瘍の増大に必須の要件である。血管新生はウイルスベクターで腫瘍に組み込むことが可能ないくつかの遺伝子で妨げることができ、血管新生の抑制と腫瘍内部の酸素欠乏を引き起こすことができる。担癌マウスにアンギオスタチンとエンドスタチンの遺伝子を含むウイルスを感染させることで、腫瘍成長が阻害された。抗血管新生抗体の遺伝子を含む牛痘ウイルスと血管新生を阻害するHSV1716変異を持つ牛痘ウイルスで、抗癌活性の増強が示された。
放射性ヨウ素
ヨウ化ナトリウム共輸送体(NIS)遺伝子を付加されたウイルスを腫瘍細胞に感染させると、腫瘍細胞にNISが発現しヨウ素が集積される。放射性ヨウ素を用いた治療と組み合わせると、腫瘍局所への放射線治療が可能となり、甲状腺癌の治療に用いることができる。ガンマカメラを用いると放射性ヨウ素の集積箇所を可視化でき、ウイルスの感染箇所を確認できる。この手法はアデノウイルス、麻疹ウイルス、牛痘ウイルスでそれぞれ前臨床試験が成功している。
宿主免疫との相互作用
抑制的作用
腫瘍溶解性ウイルスの奏効に対する大きな障害は、ウイルスを不活性化しようとする患者の自然免疫系である。静脈注射されたウイルスは血中の補体および中和抗体との相互作用に耐える必要があり、問題になることがある。
化学療法で免疫を抑制したり補体を阻害したりすることで腫瘍溶解性ウイルスの作用を増強することができる。
既存の免疫はヒト病原体として一般的でないウイルスを用いることで、ある程度は回避できるが、その後の抗体産生を抑止することはできない。しかし、一部の研究では腫瘍溶解性ウイルスへの既存の免疫がその有効性を大幅に減少させるものではないことを示している。
それとは別に、ウイルスベクターをポリエチレングリコールなどのポリマーで包み、抗体から保護するという方法もあるが、ウイルスを包んでしまうと目的とする細胞に侵入できなくもなる。
その他のアプローチとして、注射後のウイルスをマクロファージの中に隠す方法が考えられる。マクロファージは組織が破壊されている場所―特に癌の中心などの低酸素状態の部位―に自動的に移動するので、腫瘍溶解性ウイルスを腫瘍に到達させることができる。これは、前立腺癌を用いた動物実験で実証されている。
活性化作用
ウイルスを不活性化して腫瘍溶解性ウイルスのハードルとなる患者の自然免疫はその一方で、抗腫瘍効果の面ではウイルス療法と連携する。ウイルスへの感染は、免疫系の作用を腫瘍に向けて発動させ、抗腫瘍免疫を長期間持続させる。これは本質的には、体内で癌ワクチンを生成することに相当する。
癌の自然寛解が多数報告されている。その原理は完全には理解されていないが、突然の免疫応答または感染の結果である可能性が高いと考えられている。癌ワクチン(癌細胞から分泌される物質あるいは選別された癌抗原)や、皮膚癌については免疫刺激因子を用いて腫瘍を直接治療する試みがなされている。いくつかの腫瘍溶解性ウイルス、特にサイトカインや他の免疫刺激因子を放出するウイルスは強い免疫原性を持ち、抗腫瘍免疫応答を誘導する。
既存の癌治療法との併用
腫瘍溶解性ウイルスがしばしば最も有望と思われた使用法は、負の側面のない相乗効果を有する従来の癌治療法との併用においてである。
前立腺癌の治療に関する、前立腺選択的アデノウイルスであるCV706と放射線療法との併用療法のマウスでの実験結果が2001年に報告された。その結果、細胞死の相乗的増加とウイルス量の爆発的増加(感染細胞の融解後に放出されるウイルス粒子数の増加)が見られた。ウイルスの特性の変化は見られなかった。
SEPREHVIR(HSV-1716)もまた前臨床研究でいくつかの癌化学療法との相乗効果を示している。
Onyx-015は2000年代前期に開発が中止されるまでは化学療法との併用療法が試験されていた。併用療法はそれぞれの単独療法よりも大きな反応を見せたが、決定的とはいえなかった。
抗血管新生薬であるベバシズマブ(抗VEGF抗体)は腫瘍溶解性HSVの炎症反応を減弱し、マウスでのウイルス療法を増強する。
臨床試験
2014年7月時点で、少なくとも12種類のウイルスで臨床試験が実施されている。この中には、アデノウイルス科、ピコルナウイルス科、ヘルペスウイルス科、パラミクソウイルス科、パルボウイルス科、レオウイルス科、ポックスウイルス科、レトロウイルス科、ラブドウイルス科が含まれている。
- オンコリン:アデノウイルスH101を基にしている。2005年に中国で頭頸部癌の治療について承認された。
- タリモジェン ラヘルパレプベク(OncoVEX GM-CSF):単純ヘルペスウイルス(HSV-1)由来である。2013年3月、進行悪性黒色腫を対象にした第III相臨床試験が終了した。恐らく西欧で初めての腫瘍溶解剤として承認される見込みである。膵癌治療については第I相、シスプラチン化学療法および放射線療法併用頭頸部癌治療については第III相の段階にある。
- レオライシン:頭頸部癌の治療法として第三相臨床試験を実施中である。中間解析の結果、治療開始6週後で既に充分な腫瘍縮小効果が得られていることが判ったが、試験は全生存期間のデータを完全に得られる前に終了する。結腸直腸癌の治療について有望な結果が得られている。合計31の臨床試験が終了または進行中であり、各種固形腫瘍に対する標準化学療法との組み合わせも数多く試験されている。
- JX-594:hepatocellular carcinomaに対する第II相臨床試験が実施中である。JX-594はチミジンキナーゼ抹消牛痘ウイルスとGM-CSFを結合したものである。
- SVV-001(NTX-010):腫瘍溶解性ピコルナウイルスである。小細胞肺癌(en:small cell lung cancer)ならびに神経芽細胞腫に対する第III相臨床試験が進行中である。
- ColoAd1:かつて指向進化の手法で開発された。第I相臨床試験の症例登録は転移を有し標準的治療の選択肢がない患者を対象とし、成功裏に終了した。その結果、点滴静注されたウイルスが腫瘍に到達して増殖する証拠が得られた。次の臨床試験は結腸直腸癌を対象に2014年に始められる予定であった。他の腫瘍溶解性ウイルスと異なり、ColoAd1は腫瘍内への直接投与よりも点滴静注で投与することが良いとされる。次期試験では腫瘍内投与と点滴静注とを比較し、より良い投与法を決定する(EU臨床試験登録機関を参照)。その次の臨床試験は2015年8月現在、卵巣癌、原発性腹膜癌、卵管癌を対象として実施中である。
- SEPREHVIR(HSV-1716):膠芽腫ならびに頭頸部の扁平上皮癌に対する第I相臨床試験が終了した。HSV-1716の腫瘍内投与法の用量探索試験が小児・成人の非中枢神経系固形腫瘍を対象に実施されており、また中皮腫に対する新たな第I/II相臨床試験が2012年に開始された。
- ONCOS-102(Ad5/3-D24-GMCSF):第I相臨床試験では開発企業の先進医療受給プログラムで200人の患者が治療された。
- GL-ONC1:固形腫瘍に対する点滴静注投与法についての第I相臨床試験の段階にある。別に、癌性胸水のある患者に対する胸腔内投与、進行腹膜癌症患者に対する腹腔内投与、頭頸部癌に対する複合療法の臨床試験が実施されている。
- Cavatak:コクサッキーウイルスである。悪性黒色腫に対する第II相臨床試験が進行中である。
- MV-NIS:形質細胞性骨髄腫を破壊する遺伝子改変麻疹ウイルスである。NISの遺伝子発現の確認には放射性ヨウ素を用いた映像化技術が用いられる。
- TBI-1401(HF10):単純ヘルペスウイルス1型自然変異株である。再発性乳癌および再発性頭頸部癌に対する初期臨床研究が終了した。頭頸部癌に対する第I/II相臨床試験が米国で実施されている。日本では表在性病変を有する各種固形腫瘍に対する第I相臨床試験および進行膵癌に対する初期臨床研究が進行中である。
- テロメライシン(OBP-301):遺伝子組み換え5型アデノウイルスである。テロメラーゼ活性のない細胞内では増殖しない。感染細胞内で転写因子E2F1を増加させ、アポトーシス抑制蛋白質であるMCL1を減少させる。米国で各種固形腫瘍に対する第I相臨床試験が終了した。食道癌、頭頸部癌、肺癌に対する初期臨床研究が実施されている。肝細胞癌に対する第I/II相臨床試験を実施中である。
- G47Δ:遺伝子組換え単純ヘルペスウイルスである。進行性膠芽腫に対する医師主導第II相臨床試験が実施された。また再発性前立腺癌に対する医師主導臨床試験が実施されている。
架空の使用例
SFの世界では、腫瘍溶解性ウイルスはジャック・ウィリアムスンの『超人間製造者』(1951年 翻訳1968年)が初出であるが、哺乳類に感染するウイルスというより寧ろバクテリオファージに近い。『超人間製造者』はまた「遺伝子工学」という用語を導入したことでも知られる。
米国の映画『アイ・アム・レジェンド』は、癌治療に用いたウイルスが突然変異して全世界に流行したという設定になっている。
フレッド・セイバーヘーゲンのSF短編集 Berserker (1967)(邦訳『バーサーカー 赤方偏移の仮面』、ハヤカワ文庫SF、1980年) の一編「和平使節」The Peacemaker (1964) には、人類及び他の惑星の知的種族全ての抹殺を至上命題とする殺戮機械軍団「バーサーカー」の1機を巧妙に欺いて、人体の正常細胞のサンプルと称してがん細胞のサンプルを渡し、バーサーカーのテクノロジーを利用して腫瘍溶解性ウイルスを合成させるエピソードがある。
関連項目
- ウイルス療法
- 腫瘍溶解性ヘルペスウイルス
- 腫瘍溶解性アデノウイルス
- 腫瘍ウイルス―腫瘍を誘発するウイルス
- ヒト甲状腺ヨウ化ナトリウム共輸送体を発現する麻疹ウイルス(MV-NIS)
関連文献
- Harrington, Vile, Pandha (2008). Viral Therapy of Cancer. Hoboken, N.J.: Wiley. ISBN 0470019220. https://books.google.co.jp/books?id=7D54wqngF1QC&printsec=frontcover&redir_esc=y&hl=ja#v=onepage&q&f=false
- Thorne, Kirn, Liu (2011). Oncolytic Viruses: Methods and Protocols (Methods in Molecular Biology). New York: Humana Press. ISBN 1617793396
- Sinkovics (2005). Viral therapy of human cancers. New York, NY: Dekker. ISBN 0824759133
出典
外部リンク
- 日本で開発中の腫瘍溶解性ウイルス (臨床研究・治験) - NIHS
- 腫瘍溶解性ウイルスは「抗がん剤」と成り得るか?|名古屋大学大学院 医学系研究科 消化器外科学
- ウイルス療法の臨床研究に関するQ&A|東京大学医科学研究所附属病院 脳腫瘍外科
- ウイルス医薬品|一般向けページ|大阪府立成人病センター研究所
- 腫瘍溶解性ウイルス療法とは - 東京薬科大学 生命科学部